【中睿行业分享】阿尔茨海默

免责声明:本文内容仅供读者参考,不作为任何投资建议;股市有风险,投资需谨慎。
01
基本概述
(一)疾病简介
阿尔茨海默病(Alzheimer’s disease,AD)俗称老年痴呆、痴呆症,是一种发病进程缓慢、随着时间不断恶化的神经退化性疾病。
最常见的早期症状为丧失短期记忆(难以记住最近发生的事),当疾病逐渐进展,症状可能逐渐出现,包括语言障碍、定向障碍(包括容易迷路)、情绪不稳、丧失动机、无法自理和许多行为问题。
当情况恶化时,患者往往会因此和家庭或社会脱节,并逐渐丧失身体机能,最终导致死亡。
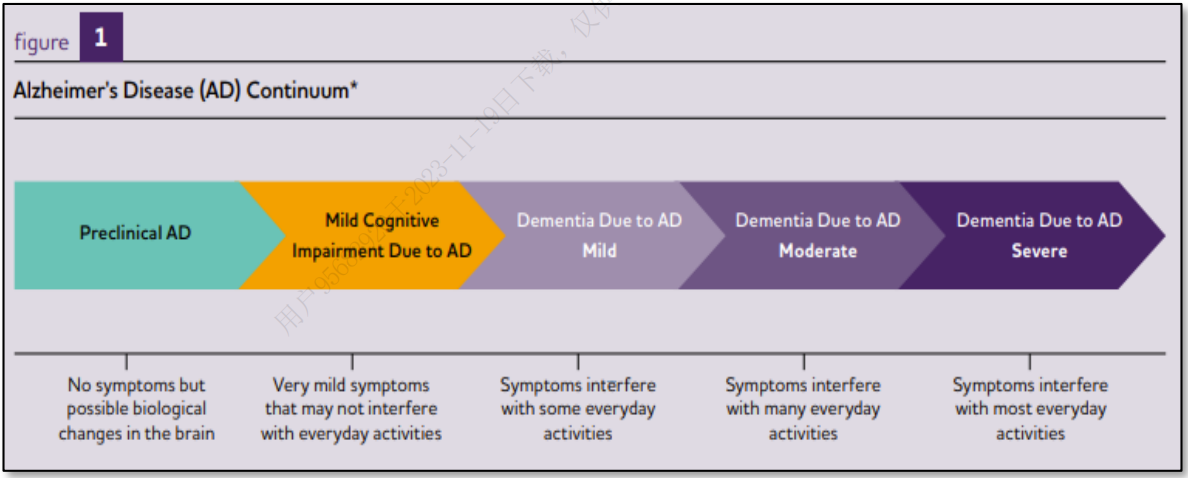
AD的发展过程主要分为三个阶段:
临床前AD(preclinical AD)
AD源性轻度认知障碍(mild cognitive impairment,MCI)
AD源性痴呆(dementia due to AD)
MCI具有向AD痴呆转归的高可能性,约1/3会在3- 5年内进展为痴呆症。
AD的真正成因至今仍然不明,目前将阿尔茨海默病视为一种神经退化的疾病,并认为有将近七成的风险因子与遗传有关;
其他的风险因子还有头部外伤、忧郁症和高血压。
从AD病理在组织学水平上的特点来看,AD疾病的进程与大脑中的Aβ蛋白和Tau蛋白的沉积有关,从而导致神经细胞整体退化,并最终干扰神经系统的高级功能。
图:AD疾病发展过程
(二)患者基数
WHO报告显示,目前全球约有5000万痴呆症患者,其中60%-70%为AD患者。
根据2021年《阿尔茨海默病源性轻度认知障碍诊疗中国专家共识》,中国流行病学调查显示,中国60岁以上人口中痴呆患者约1507万,其中AD约983万人(患病率4%),是世界上AD及其他痴呆患病人数最多的国家,另有MCI约3877万人(患病率15.5%)。
2019年,导致我国人群死亡的前5位疾病分别为脑血管疾病、缺血性心脏病、慢性阻塞性肺疾病、肺癌和AD。
过去30年间,我国因AD导致死亡的顺位从1990年的第10位上升至2019年的第5位。这意味着AD的发病率和死亡率都远超其它疾病。
图:1990年至2019年我国主要疾病死因顺位变化

(三)现有治疗方案
海外两大指南均一致推荐FDA批准的乙酰胆碱酯酶抑制剂AChEI和美金刚为AD的一线治疗药物,无论是从其病理机制还是临床大量的研究均验证了其疗效的有效性和安全性。其中AChEI可治疗轻度、中度AD患者的认知和非认知症状;
美金刚则可治疗中、重度AD患者认知和非认知症状。
但这两款产品一是开发时间过早,已经超过50年;二是并非专门针对AD所开发。
在中国,根据阿尔茨海默病的诊疗规范(2020 年版),针对AD的治疗主要包括改善认知的药物和针对精神行为症状的药物治疗及非药物干预。改善认知药物就包括前面讲的AChEI和美金刚。
图:国内目前AD推荐药物治疗
02
最新AD创新药突破
(一)Biogen/卫材AD新药Lecanemab获批上市
Lecanemab(仑卡奈单抗)是由Biogen和卫材合作开发的一款针对阿兹海默症(AD)的产品,可减缓阿兹海默症患者的神经退行过程。
2022年9月28日,卫材和Biogen共同宣布III期临床达到了主要临床终点和所有关键次要临床终点,该临床试验是一项全球多中心试验,共涉及北美、欧洲和亚洲的235个研究中心。
实验结果显示:在治疗18个月之后,在早期AD患者中,lecanemab相比安慰剂降低了27%疾病进展至下一阶段的风险,并且从治疗6个月起到所有时间点,lecanemab均能显著降低进展风险,并且在不同认知功能状态以及不同亚组(人种、民族、合并症)之间均证实了结果的一致性。
这表明lecanemab(仑卡奈单抗)可以延缓疾病进展达7.5个月。
此外,仑卡奈单抗还能维持患者健康相关的生活质量,减轻照料者的负担。认知和功能、疾病进展、健康相关的生活质量以及照料者负担等方面的证据共同表明,仑卡奈单抗治疗可为患者、照料者、临床医生和社会带来有积极的益处。
Lecanemab获批历程:
2022年7月,美国FDA加速审批受理了lecanemab的上市申请,并给予了优先审评。
2023年7月6日,FDA官网显示卫材/渤健联合开发的lecanemab用于治疗阿尔茨海默症(AD)的加速批准已成功转为完全批准。这也意味着lecanemab成为了20年来首款获得FDA完全批准的AD新疗法。
Lecanemab美国定价:
分别为254.81美元/200mg和637.02美元/500mg,推荐剂量为10mg/kg,每两周静脉给药一次,按照75kg的体重计算,则每位患者的年治疗费用为2.65万美元。
Lecanemab中国进展:
2022年12月22日,lecanemab在中国的上市申请获国家药监局受理,适应症为轻度阿尔茨海默症(AD)和阿尔茨海默症(AD)引起的轻度认知障碍(MCI)疾病的改善治疗。
2024年1月9号,正式在中国获批上市。
(二)礼来donanemab提交上市申请
2023年7月17日,礼来在阿尔茨海默病协会国际会议(AAIC)上发布了单抗Donanemab的III期临床试验完整结果,同步发表于《美国医学会杂志》(JAMA)。
该试验研究旨在评估Donanemab在早期症状性阿尔茨海默病患者中的有效性和安全性。
结果显示:无论疾病基线和病理阶段如何,与安慰剂相比,Donanemab都能带来认知和功能益处。
从年龄组的角度来看,donanemab对75岁以下的患者具有更大的获益:在75岁以下的受试者中,donenamab使下降减缓了48%;在75岁或以上的受试者中,donanemab使下降减缓了25%。
此外,donanemab对处于疾病早期阶段的患者具有更大的获益:在患有轻度认知障碍的受试者中,Donanemab使下降减慢了60%;对于阿尔茨海默病源性轻度痴呆患者,Donanemab使下降延缓了30%。
基于上述试验结果,礼来已经于2023Q2向FDA提交了上市申请,并预计将于2024年内得到监管反馈。
03
在研管线梳理
Alzheimer’sDement杂志对AD领域在研药物进行了梳理,截至2023年,全球有超过140个药物在进行近200项针对AD的临床试验。

目前,在国内已经进入临床阶段的针对AD的新药共有34款,其中:
处于III期及以后的产品以进口产品为主,比如前面已经获批的lecanemab和礼来的donanemab。
国产新药中,绿谷制药的甘露特纳已获批上市,长春华洋/通化金马的八氢氨吖啶已处于III期临床,处于II期临床的有康缘药业、先声药业、海正药业等公司的产品,处于I期临床的有先声药业、东阳光、恒瑞医药、新华制药等公司的产品,批准临床的有信立泰、石药集团、百克生物等公司的产品。
04
总结
如前所述,阿尔茨海默症AD是一种发病率持续抬升、死亡率抬升且临床未满足的不治之症,而且AD不仅会给患者造成不可逆的伤害,对于家庭也会带来很大的照护负担和心理负担。
根据《阿尔茨海默疾病经济负担及承担主体职责研究》,AD患者平均疾病经济负担高达8-12万元/年,年平均照料者劳动损失高于药品花费。唯一解决之道就是早发现、早治疗、终身管理。
因此,早期治疗的药物将迎来巨大的增量市场,而2023年已经有20年来首款获得FDA完全批准的AD新疗法出现,后续礼来和诺和诺德等top药企的重磅产品也都在路上,产业趋势渐近。
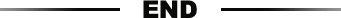
免责声明:本报告中的信息所表述的意见并不构成对任何人的投资建议。任何情况下,本公司不承担以本报告为基础进行的任何投资活动所可能导致的风险。




